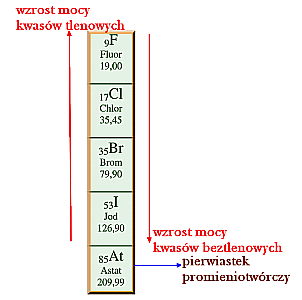
Azot jest jednym z głównych składników powietrza oraz wielu związków budujących organizmy. Fosfor nie występuje w stanie wolnym, a tylko w związkach (nie znosi życia jako singiel).
Azot jest gazem, pozostałe substancjami stałymi. Fosfor występuje w 10 odmianach alotropowych, a najczęściej spotykane są 3:
1) fosfor biały (P4) należy przechowywać pod wodą, bo zapala się w powietrzu i jest bardzo toksyczny.
2) fosfor czerwony powstaje podczas ogrzewania fosforu białego
3) fosfor czarny ma metaliczny połysk i przewodzi prąd, jest mało aktywny chemicznie. Arsen występuje jako arsen szary, żółty i czarny. A antymon ma odmianę mataliczną i bezpostaciową – czarną.
Azotowce są nieaktywne chemicznie. Tworzą wiązania kowalencyjne. Przyjmują stopnie utlenienia od -III do V. Najważniejsze związki z metalami to azotki np. Li3N oraz fosforki np. Na3P, w których azotowiec przyjmuje stopień utlenienia -III.
Trudno łączą się z tlenem, jedynie fosfor biały i przy tym świeci (P4O10) Fosfor tworzy dwa istotne tlenki: P2O5 i P4O10. Z wodą tworzą kwasy.
P4O10 + 2 H2O –> 4 HPO3
P4O10 + 4 H20 –> 2 H2P2O7
P4O10 + 6 H2o –> 4 H3PO4
Charakter chemiczny tlenków:
Obojętne: N2O i NO
Kwasowe: tlenki azotów od IV stopnia utlenienia oraz tlenki fosforu
Arsen, antymon i bizmut na V stopniu są kwasowe, a na III (prócz bizmutu) amfoteryczne.
Bi2O3 jest zasadowy.
Wodorek azotu (amoniak) ma charakter zasadowy. Pozostałe wodorki są obojętne.
AZOT: Tworzy cząstki dwuatomowe. Bezbarwny, bezwonny i bez smaku. Rozpuszcza się gorzej od tlenu.
Reakcje z amoniakiem:
NH3 + HNO3 –> NH4NO3
Pod wpływem ogrzewania ulega rozkładowi z wydzieleniem gazowego amoniaku:
NH4CL –> NH3 + HCl
Cząstka NO ma jeden niesparowany elektron przez co jest bardzo aktywny. Łatwo utlenia się w powietrzu do tlenku azotu (IV) który jest brunatnym, trującym gazem o duszącym zapachu. Tlenek azotu (IV) tworzy w wodzie dwa kwasy:
2 NO2 + H2O –> HNO2 + HNO3
Stężony roztwór kwasu azotowego (V) jest tak silnym utleniaczem, że wiele substancji zapala się w nim, jak w czystym tlenie.
4 HNO3 + C –> Co2 + 4 NO2 + 2 H2O
ZASTOSOWANIE: Arsen: – dodatek do brązów, produkcja materiałów półprzewodnikowych
Azot: – buduje białka i witaminy.
Fosfor: – Składnik kwasów nukleinowych, kości i związków ATP.
Bizmut: – Daje niską temp. topnienia.
Antymon: – Odlewanie czcionek drukarskich.
Fosfor: – Biały – produkcja bomb. Czerwony – draski na pudełkach zapałek.