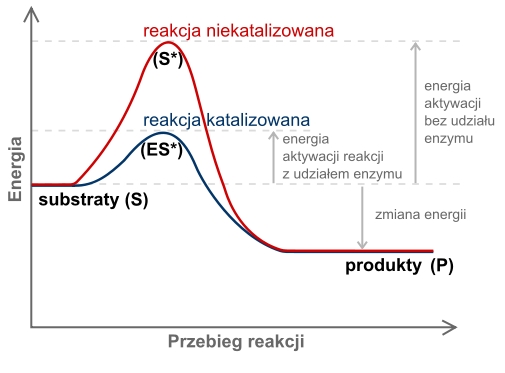
Aby zaszła reakcja trzeba dostarczyć odpowiednią ilość energii tzw. ENERGIĘ AKTYWACJI. W niskich temperaturach do zainicjowania reakcji potrzeba KATALIZATORA, który obniża energię aktywacji. W komórkach tą f-cję pełnią ENZYMY.
BUDOWA ENZYMÓW
Prawie wszystkie są białkami (oprócz rybozymy (cząsteczki RNA) i deoksyrybozymy (DNA)). Mogą składać się z samych białek jak np. pepsyna, ale najczęściej składają się z dwóch elementów: części białkowej zwane APOENZYMEM i części niebiałkowej zwane KOFAKTOREM. Tym nie-białkiem mogą być metale lub jakieś tam cząstki organiczne. Nieorganiczne są nie rozwodzą się tzn. łączą się z apoenzymem trwale, a te drugie luźno (KOENZYMY) ale niektóre są fajne i mogą również trwale (GRUPY PROSTETYCZNE). Do koenzymów należą ATP, NAD+, FAD, NADP+ oraz witaminy. Grupą prostetyczną jest pochodna B1 w dehydrogenazie pirogronaniowej. W obrębie enzymu znajduje się CENTRUM AKTYWNE. W tym miejscu wiążą się cząsteczki substratu i ewentualnie część niebiałkowa. Zawiera ono grupy funkcyjne aminokwasów, które tworzą wiązania niekowalencyjne i oddziaływania chemiczne. Są też takie trochę inne enzymy zwane ALLOSTERYCZNYMI, które składają się z kilku podjednostek, a każda z nich ma swoje centrum aktywne. Oraz oprócz tego mają również miejsca allosteryczne, do których podłączają się cząsteczki regulatorowe, które mogą zmieniać kształt centrum w zależności od potrzeb i najczęściej rozpoczynają pierwszą reakcję.
WŁAŚCIWOŚCI ENZYMÓW
Cechują się tzw. swoistością substratową czyli dany enzym łączy się tylko z daną substancją (np. maltaza z maltozą).
Oraz swoistością katalizowanej reakcji czyli jeden enzym katalizuje reakcje tylko jendego typu.
ENZYM-SUBSTRAT
Pod wpływem substratu centrum aktywne zmienia swój kształt. Nazywa się to MODELEM INDUKOWANEGO (wymuszonego) DOPASOWANIA.
CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI
1) Stężenie – wzrost stężenia substancji zwiększa szybkość aż do osiągnięcia maksymalnej wartości. Dalej nic się nie dzieje, bo enzym wysycił się już substratem i więcej nie chce. Takie stężenie przy którym szybkość reakcji osiąga połowę szybkości maksymalnej nazywa się STAŁĄ MICHAELISA. Stała ta opisuje powinowactwo enzymu do substratu czyli im większa wartość tym mniejsze powinowactwo i mniejsza efektywność enzymu.
2) Temperatura – Wzrost o 10 stopni C, średnio dwukrotnie zwiększa szybkość reakcji, ale tylko w określonych granicach. Dalszy wzrost spowoduje opóźnienie. Przyczyną jest denaturacja białka.
3) Wartość pH – Większość enzymów jest aktywna w środowisku zbliżonym do obojętnego, ale np. enzymy lizosomów w lekko kwaśnym, a enzymy trawienne tylko w określonym dla nich, konretnym PH. Pepsyna woli kwasowe, trypsyna zasadowe.
4) Stężenie soli – musi być określone.
5) Substancje aktywujące i hamujące – AKTYWATORY zmieniają strukturę centrum aktywnego, mogą być to jony metali i drobne cząstki organiczne. INHIBITORY hamują przebieg reakcji:
– Hamowanie nieodwracalne – inhibitory przyłączają się do centrum za pomocą wiązań kowalencyjnych i enzym już działać nie może. Tak działa większość trucizn np. cyjanek potasu, ale niektóre też są ważnymi lekami.
– Hamowanie odwracalne – KOMPETENCYJNE – wyścig inhibitorów i substratów, inhibitor wygrywa, łączy się z centrum aktywnym. NIEKOMPETYCYJNE – wiążą się w innym miejscu niż centrum aktywne przez co zmienia się kształt białka.
SZLAKI METABOLICZNE
Są to ciągi następujących po sobie reakcji, w których produkt jednej jest substratem drugiej.
2) Szlaki liniowe – ciąg reakcji przebiegający zawsze albo do syntezy albo do rozkładu określonej substancji.
1) Szlak cykliczny – następuje w nim odtworzenie jednego ze związków chemicznych, jest on jako produkt końcowy, po czym staje się substratem dla kolejnej reakcji rozpoczynającej cykl.
REGULACJA PRZEBIEGU SZLAKÓW METABOLICZNYCH
– Ujemne sprzężenie zwrotne – produkt reakcji hamuje aktywność enzymów
– Przyłączanie aktywatorów lub inhibitorów
– Dodawanie lub odłączanie reszt fosforanowych (fosforylacja i defosforylacja enzymów)
– Wydzielanie nieaktywnych PROENZYMÓW (zwanych również ZYMOGENAMI) pozwala to na ich aktywację (nieodwracalna hydroliza wiązania peptydowego) w miejscu, gdzie są potrzebne.
– Degradacja zbędnych lub uszkodzonych enzymów. Te niedziałające zbyt dobrze rozpoznawane są przez receptory w błonie lizosomów i rozkładane dzięki PROTEOLITYCZNYM ENZYMOM LIZOSOMALNYM (dobrze to odmieniłam??). Jest też inny sposób: UBIKWITYNOZALEŻNA DEGRADACJA BIAŁEK. Enzymy zostają wówczas oznakowane przez cząsteczki UBIKWITYNY, które są takimi strażnikami wysyłającymi je na śmierć. Ubikwityna wskazuje białka które wkrótce będą martwe (nazywana jest znakiem śmierci). Białka te rozkładane są w obrębie PROTEASOMU.
